Citat nr. 1: Epigenetics is currently one of the most active research domains in biology (Nocoglou & Merlin 2017).
Citat nr. 2: Epigenetics, the study of non-DNA sequence−related heredity, is at the epicenter of modern medicine because it can help to explain the relationship between an individual’s genetic background, the environment, aging, and disease (Feinberg 2008).
Citat nr. 3: Den information, som påvirker genarkitekturen, findes ikke i vores genetiske kode, men i modifikationer omkring vores DNA. Og det har vist sig, at denne information bliver kopieret og givet videre i lighed med den genetiske kode, når vores celler deler sig. Vores celler indeholder altså anden “arvelig” information end den genetiske kode. Med den erkendelse er forskning i såkaldt epigenetik stormet frem i den internationale forskningsverden de seneste år. Resultaterne har på flere punkter vendt op og ned på vores forståelse af helt grundlæggende forhold omkring organismers udvikling og sygdommes opståen, og det har udfordret vores opfattelse af, at den genetiske kode eksklusivt betinger disse processer (Sonne-Hansen et al. 2014).
Epigenetik, som er græsk for ”ovenpå genetik”, blev defineret første gang af C. H. Waddington i 1942 (Nicoglou & Merlin 2017). Det er således ikke noget nyt begreb, men forståelsen af, hvad epigenetik er, har udviklet sig meget, siden Waddington definerede det. I dag, mere end et halvt århundrede senere, bruges begrebet epigenetik oftest om funktionelle forandringer af genomet, uden at det involverer ændringer i selve DNA’et (Sonne-Hansen et al. 2014). Sagt på en anden måde handler det om, hvordan adfærd og miljø kan forårsage ændringer, som kan slukke eller tænde, altså inaktivere eller aktivere, vores gener. Man taler om fænotypen som det konkrete fysiske udtryk af en organismes genotype. I modsætning til genetiske ændringer er epigenetiske ændringer reversible og ændrer ikke generne, men påvirker altså, hvordan cellen aflæser et gen, som er en sekvens af DNA’et.
En stor del af nutidens forskning handler om de molekylære forandringer, der finder sted omkring DNA’et som respons på aktivitet i cellens nære og fjernere omgivelser. Da de epigenetiske faktorer menes at spille en betydelig rolle, især i udvikling af kræft og livsstilssygdomme foretages forskningen med håbet om at udvikle nye behandlinger i form af epigenetik-baserede terapier og diagnostik (Donkin et al. 2016).
Epigenetik kan altså på den ene side ses som et gammelt begreb, men samtidig beskriver de indledende citater epigenetik som et epicenter og et af de mest aktive forskningsdomæner inden for biologi og medicin. Dette er i sig selv en god grund til at undersøge begrebet nærmere, men desuden ser jeg det som en interessant kanal mellem omgivelser, psyke og krop. Med det afsæt er det meningen, at blogindlægget skal give en indledende og overordnet forståelse, og derfor vil der nødvendigvis være både forenklinger og udeladelser i præsentationen af dette store emne.
Intro til epigenetik
Jeg har valgt at tage afsæt i nogle udklip fra en TEDx-event på Youtube, fordi foredragsholderen Courtney Griffins’ præsentation giver en god indføring i de forskellige aspekter af begrebet[1].
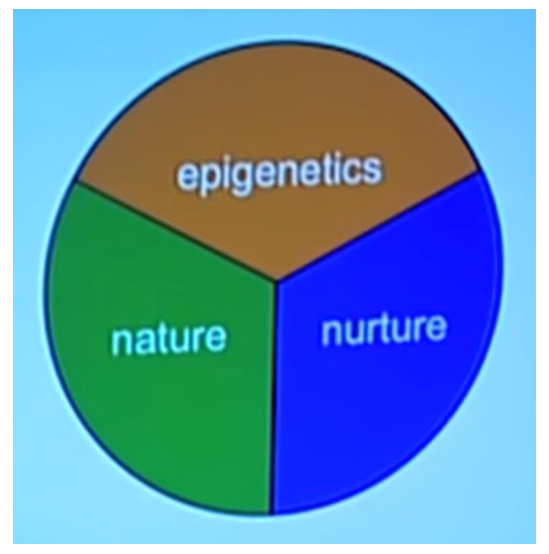
I det første videoklip bruger Griffins enæggede tvillinger som eksempel til at illustrere forholdet mellem arv (DNA/gener) og miljø (omgivelser) – på engelsk kaldet Nature and Nurture – og hvordan epigenetik kan forstås i forhold til dette.
Jeg vil mene, at det kan diskuteres, om epigenetik er en tredje faktor, som det fremstilles i figuren fra Griffins. Jeg vil i blogindlægget vise, at det snarere er en forbindelseskanal mellem omgivelser og gener.
Lad os med det næste videoklip se lidt nærmere på DNA og gener.
Kromatin og epigenetisk mærkning af generne
Efter Griffins’ udmærkede forklaring tager vi lige begreberne på skrift: Menneskets DNA består af tre mia. nukleotider fordelt i 23 par af kromosomer. Men den funktionelle del af DNA’et er vores gener, som er mindre stykker af det samlede DNA. Hvert gen rummer opskriften på et protein eller andre molekyler, som den menneskelige krop er bygget op af. Kromatin dannes af DNA, som ligger stramt rullet rundt om histoner, som vist på billedet nedenfor.
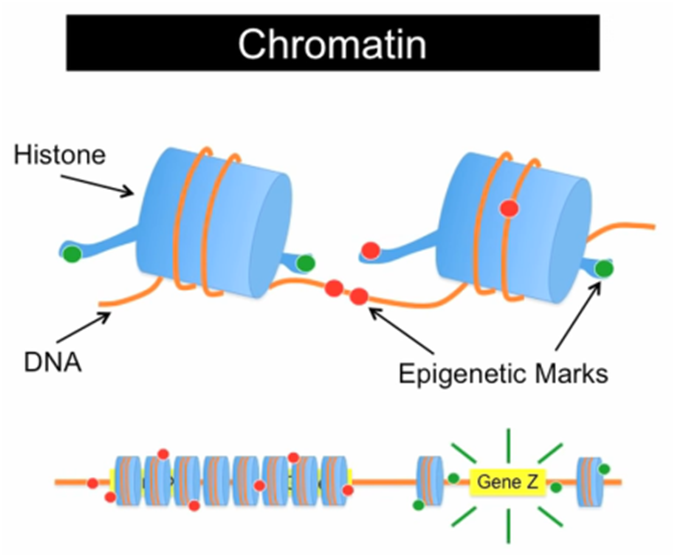
Epigenetik kan beskrives som markeringer på vores gener. Disse markeringer har betydning for genekspressionen, bl.a. for hvilke gener, der aflæses. Aflæsningen af gensekvensen afhænger bl.a. af de histoner, der pakker et DNA-molekyle ekstremt tæt sammen. Når histonerne lukker DNA op, står den genetiske kode klar til aflæsning. Hvis strukturen er tæt, kan det maskineri, som aflæser og kopierer DNA-koden, ikke komme til, og generne i området vil være slukket. Omvendt vil generne i et område med en løs kromatinstruktur have muligheden for at være tændte. Man taler således om at en epigenetisk markering kan tænde eller slukke for et gen. Eftersom alle vores celler i kroppen har samme DNA, er det bl.a. epigenetikkens signaler – som også indebærer påvirkninger fra cellens omgivelser – der er afgørende for differentieringen af de forskellige stamceller til de enkelte vævs- og cellefunktioner trods cellernes ensartede genom (Donkin et al. 2016). Epigenetik er således en af forklaringerne på, hvordan celler og organismer med identisk DNA kan have så dramatiske fænotypiske forskelle.
De tre primære klasser af epigenetiske faktorer er: 1) DNA-metylering, 2) små ikke-kodende RNA-stykker og 3) histon-modifikationer, som alle har det til fælles, at de ændrer karakter efter vores livsstil og miljøet omkring os (Donkin et al. 2016).
Epigenetik i fostertilværelsen
Fostertilværelsen er en særdeles vigtig periode, da der er meget, der tyder på, at eksponering for mange forskellige ”miljøfaktorer” tidligt i fosterudviklingen spiller en rolle for sygdom senere i livet. Eksemplet med agouti-musen viser, hvordan miljøeksponeringer kan have markant virkning gennem epigenetiske mekanismer. Man kan sige, at det er epigenetik, der giver en plausibel sammenhæng mellem miljøeksponering og sygdomsrisiko, og stress-påvirkning i fostertilstanden kan medføre udviklingsforstyrrelser (Hamilton 2011).
Tidligere troede man, at generne i form af DNA var det eneste, vi arvede fra vores forældre. Men med epigenetikken er der sket et nybrud i forståelsen af arvelighed. Se mere om nedarvning af epigenetisk mærkning i næste videoklip.
Epigenetisk mærkning kan overføres til fremtidige generationer
Det kan synes indlysende, at fx forurening eller en usund livsstil som rygning kan have indflydelse på vores eget helbred. At en persons egen adfærd og livsstil kan påvirke epigenetiske faktorer i udviklingen af kroppens celler på endda meget kort sigt, skal vi kigge på senere. Men i dette afsnit skal vi se på, hvordan risiko eller modstandskraft overfor sygdomme kan overføres gennem generationer ved at en del af vores epigenetiske information gives videre til vores børn. Epigenetiske modifikationer er tilsyneladende arvelige mellem generationer, kaldet transgenerationel arv. Forældrenes epigenetik, når undfangelsen finder sted, ser ud til at have betydning for barnet.
Et ofte fremlagt eksempel på miljøeksponering og dens effekt på epigenetik er de gravide kvinder, som blev ramt af den hollandske hungersnød i 1944-45. Det viser sig i undersøgelser 60 år efter hungersnøden, at børn af disse kvinder, som voksne har øget forekomst af hjerte-kar-sygdomme, overvægt, sænket glucosetolerance, obstruktiv lungesygdom og meget andet (Painter et al. 2005).
Da fostrene imidlertid selv var udsat for miljøpåvirkningen, er der ikke tale om ren overførsel af epigenetiske modifikationer til den efterfølgende generation. Det kan dog også forholde sig således, at moderen var ramt af hungersnød ved undfangelsen, og så vil det være en blanding af epigenetik og miljøeksponering.
Alligevel har viden fra disse såkaldte Dutch Hunger Winter-kohorteundersøgelser har været med til at danne hypotesen om, at vi gennem ændringer i vores livsstil, fx kost og motionsvaner, kan påvirke den epigenetiske signatur, vi sender videre til vores børn gennem æg- og sædceller. Det er fx vist, at overvægtige mænd har en anden epigenetisk profil i sædcellerne end normalvægtige mænd. Hvis vores diæt som vordende forældre kan påvirke epigenetikken i vores æg- og sædceller og derigennem ændre fosterets udvikling, kan det forklare, hvorfor børn af overvægtige mænd har en større risiko for selv at blive overvægtige, uafhængigt af moderens kropsvægt (Donkin et al. 2016). En støtte til denne hypotese er forsøg på rotter, der viser, at overvægtige hanners epigenetiske information i sædcellen hænger sammen med ungens forringede glukoseomsætning, som man forbinder med type 2 diabetes og fedme. Og desuden viser helt ny forskning, at fædres rygevaner, især i puberteten, er forbundet med øget risiko for barnet ift. astma, lav lungefunktion og overvægt (Kitaba et al. 2023).
Det har vist sig, at nogle epigenetiske mærker bliver visket væk og nogle bliver siddende. Så der er stadig diskussion om de underliggende mekanismer og omfanget af den transgenerationelle arv hos mennesker, men Xavier et al. (2019) konstaterer, at det i stigende grad er tydeligt, at de epigenetiske modifikationer spiller en stor rolle i at bestemme fænotyperne af individer og deres afkom; og forskerne sammenfatter, at der er stærke beviser for, at der kan skabes stabile epigenetiske effekter, der kan blive overført fra forældre til afkom, hos både mennesker og gnavere.
Epigenetiske mærker kan akkumulere efter fødslen
Epigenetik kan også overføres via det miljø, som barnet fødes ind i og udvikler sig i. Eksemplet med rottemoderens plejende adfærd viser, at der kan forekomme markante epigenetiske modifikationer i løbet af den første uge af ungens liv. Voksne rotter, som har modtaget denne plejende adfærd, udviser reduceret frygt og mere beskedne reaktioner på stress i HPA-aksen end unger, som ikke blev plejet på denne gavnlige måde (Weaver et al. 2004; Jirtle & Skinner 2007).
Samaroff har fremlagt en model, som overordnet viser et barns udvikling som ”produktet” (kaldet fænotypen) af mødet mellem gener og miljø.
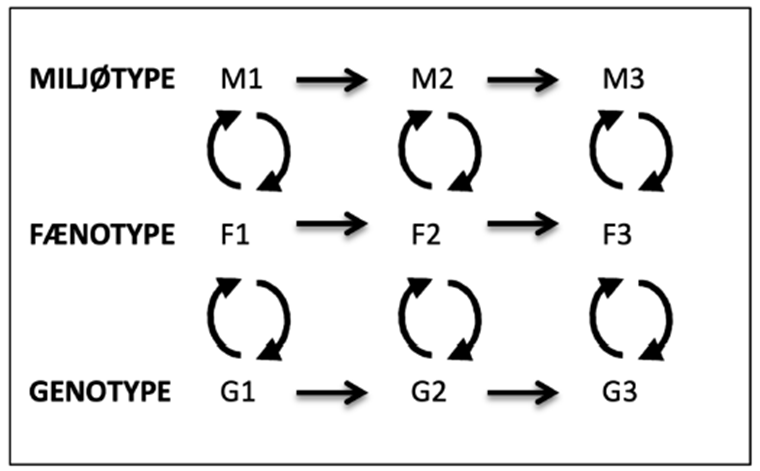
Figur 2. Sameroffs dynamiske transaktionsmodel, som illustrerer det tilbagevirkende loop imellem genotype, fænotype og miljøtype (Grønbæk & Sommer 2019, s.194).
Ifølge Grønbæk & Sommer (2019) betragter Sameroff genotype (biologisk organisering), fænotype (individets udtryk) og miljøtype (familie- og kulturelle mønstre) som transaktionelle elementer, hvori genotype og miljøtype reciprokt regulerer og reguleres af fænotypen over tid. Således understreger Sameroff, at disse samspil er mere end bare “interaktioner” eller “påvirkninger”, men snarere transaktioner, eftersom ændringer i ét system direkte forandrer aktiviteten i de andre systemer. Det betyder, at det miljø, som fx et barn er indlejret i, forandrer udtrykket i fænotypen, der forandrer udtrykket i genotypen, der igen forandrer udtrykket i fænotypen, der kan forandre miljøtypen. Derfor kan to individer med samme genotype (enæggede tvillinger) have forskellige fænotyper, mens to personer med lignende fænotyper kan have forskellige genotyper. Et individs genetiske udgangspunkt er således ikke determinerende for dennes udvikling, men udgør snarere et fundament for en række mere eller mindre sandsynlige udfald, som de epigenetiske markeringer er medvirkende til.
Igennem livet kan – og vil – livsførelsen og omgivelserne påvirke genekspressionen, fx når stamceller deler sig og giver ophav til nye datter-celler. Nyere forskning viser, at de epigenetiske faktorer er særdeles dynamiske af karakter. En enkelt kortvarig træningssession ændrer således DNA-methyleringen af specifikke gener i muskelcellerne allerede efter minutter, med efterfølgende ændringer i genekspressionen (Donkin et al. 2016).
De epigenetiske modifikationer kan altså i lighed med genetiske ændringer påvirke både vores normale udvikling og sundheds- og sygdomsudvikling. Talrige miljøeksponeringer er blevet forbundet med ændring af epigenetiske mønstre i løbet af et helt liv og efterfølgende risiko for sygdom. Specifikke eksempler omfatter tobaksrøg, alkohol og forurenende stoffer. En undersøgelse så på epigenetisk mærkning i form af methylerings- og histonmodifikationerne hos enæggede tvillinger på forskellige stadier i livet. Tidligt i livet er de epigenetiske signaturer næsten identiske, men ved 50 års-alderen blev der fundet dramatiske forskelle, hvilket tyder på, at miljøeksponeringer ændrede epigenomet (Hamilton 2011).
Epigenetiske mærker er reversible
Det viser sig heldigvis, at ikke alle epigenetiske forandringer er permanente. Nogle epigenetiske markeringer kan blive tilføjet eller fjernet som respons på ændringer i adfærd og miljø. At de epigenetiske mekanismer kan være reversible og fleksible, giver således begrundet håb om, at viden om disse mekanismer kan udnyttes til sygdomsforebyggelse og -behandling. Det er nedenstående undersøgelse af McCartney et al. (2018) om rygere, tidligere rygere og ikke-rygere et eksempel på:
Rygning kan resultere i epigenetiske ændringer. Eksempelvis har rygere en tendens til at have mindre DNA-methylering i visse dele af det såkaldte AHRR-gen end ikke-rygere. Forskellen er større for storrygere og langtidsrygere. Efter rygestop kan tidligere rygere begynde at få øget DNA-methylering ved dette gen, og det er muligt at nå niveauer svarende til ikke-rygeres. I nogle tilfælde kan dette ske på under et år, men varigheden afhænger af, hvor længe og hvor meget personen har røget, før rygeophøret.
Interaktionen mellem omgivelser og gener illustreres af nedenstående figur[2].
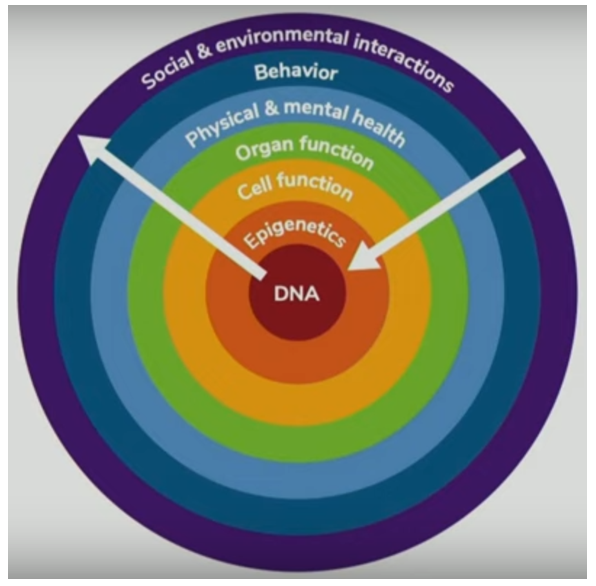
Epigenetiske processer sker på baggrund af mange forskellige faktorer i genernes “omgivelser”, fra det biologiske celle- og homeostaseniveau til adfærd, sociale faktorer og samfundsniveau.
Den højre hvide pil i figuren kan repræsentere både ’gode’ og ’dårlige’ stimuli fra individets livsførelse og det miljø, som individet lever i. Således kan livsstil og levekår være faktorer, som ’bygger robusthed’ og/eller retter op på dårlige tidligere epigenetiske markeringer, men de kan på modsat vis også være medvirkende til at afsætte dårlige – evt. sygdomsfremkaldende – epigenetiske mærker. Den hvide pil til højre viser, hvordan de biologiske processer fra DNA og celler over organfunktioner indgår i gradvis flere aspekter af personens liv, inkl. adfærd, livsstil og det sociale og øvrige miljø omkring personen. Processerne foregår hele tiden i begge retninger efter samme logik som i Samaroffs model ovenfor.
Disse overordnede principper om samspillet mellem gener og omgivelser er jo ikke nye og banebrydende. Det er vel en nogenlunde almen forståelse, at det handler om både arv OG miljø – ikke enten-eller. Men hvad er så grunden til den store opmærksomhed omkring epigenetik nutildags, som de indledende citater illustrerer?
Jeg fornemmer, at det handler om to ting: 1) Man er godt i gang med udforskningen af de molekylære mekanismer, og 2) Med viden om disse mekanismer kan man se store potentialer i udvikling af nye medicinske og terapeutiske behandlingsformer. Det vil jeg vende kort i næste afsnit.
Nye medicinske behandlingsformer
Ifølge Donkin et al. (2016) er der efterhånden konsensus om, at epigenetikken har en primær rolle i samspillet mellem miljø og genetik i flere sygdomme. Særligt vedr. psykiatriske lidelser og kræft er det påvist, at epigenetikken er en stor del af patofysiologien, og i Danmark benyttes methyleringshæmmeren azacitidin til behandlingen af bl.a. myelodysplastisk syndrom og akut myeloid leukæmi.
I fremtiden forventes det, at innovative diagnostiske tests, behandlingsformer og endda livsstilsændringer vil være baseret på epigenetiske mekanismer og blive inkorporeret i den medicinske praksis (Hamilton 2011). Det handler bl.a. om at identificere epigenetiske biomarkører for sygdom og miljøeksponering. Disse epigenetiske biomarkører vil forhåbningsvis give mulighed for tidlig diagnose af personer med en større risiko for at udvikle sygdom senere i livet. De kunne også bruges i nye forebyggende og terapeutiske tilgange, før sygdomssymptomer udvikler sig. En sådan tilgang til sygdomshåndtering kunne revolutionere behandlingen, som nu hovedsageligt behandler sygdomme, efter at de har udviklet sig (Hamilton 2011).
Sammenfatning – Epigenetik giver nye forklaringer på sammenhænge mellem miljø og krop
Epigenetikken er placeret mellem arv og miljø. Miljø kan forstås i bred forstand, såsom fostertilværelse, fysisk miljø, sociale samspil, livsstil, kultur og samfund. Gennem epigenetik er alle disse vidt forskellige miljøfaktorer i stand til at ændre genekspression og dermed fænotypen, herunder bl.a. sygdomsmodtagelighed.
Selvom det er ikke er et nyt begreb, så er epigenetikken i disse år et meget aktivt forskningsfelt. Man har i de senere år fået meget viden om de molekylære epigenetiske mekanismer, og der sker dermed i nogle sammenhænge en nyfortolkning af det klassiske samspil mellem arv og miljø. Min gennemgang i blogindlægget kan sammenfattes som følger:
- Epigenetiske markeringer på kromatinstrukturen har stor indflydelse på reguleringen af, hvordan genetisk information transskriberes, og hvordan forskellige fænotypiske udtryk skabes på baggrund af samme gener (genotype).
- Fostertilværelsen ser ud til at være en særlig vigtig periode.
- Man arver ikke bare gener, men også epigenetiske markeringer fra sine forældre, og måske også fra tidligere generationer.
- Epigenetikken påvirkes igennem livet. Da miljø og adfærd, såsom kost og motion, kan resultere i epigenetiske ændringer, er det let at se sammenhængen mellem adfærd, miljø og gener. Miljø og adfærd kan ændre omfanget af epigenetisk regulering af generne, og udforskning af epigenetik kan derfor afdække sammenhænge mellem livsstil og risiko for sygdom.
- Epigenetiske markeringer er reversible og indgår i et dynamisk samspil med en lang række aspekter af personens liv, inkl. adfærd, livsstil og det sociale og øvrige miljø omkring personen.
- Viden om epigenetiske mekanismer ses som et stort potentiale for udvikling af sygdomsbehandling.
Overordnet vil jeg konkludere, at epigenetik fremstår som et afgørende bindeled mellem arv og miljø, uanset om man taler om den mere traditionelle overordnede forståelse eller om de molekylære mekanismer, som forskningen i dag i høj grad handler om.
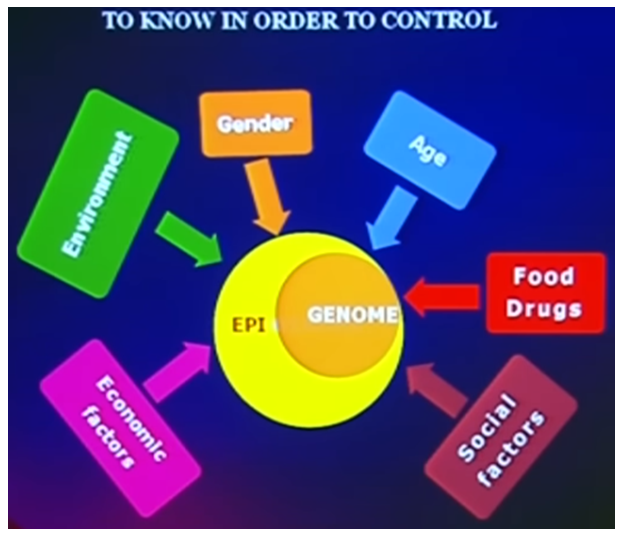
Med pointen om epigenetik som en ”bro” mellem miljøet og generne, vil jeg runde af med denne farvestrålende figur som en allersidste opsamling[3].
Litteratur
Donkin, I., Barrès, R. & Pinborg, A. (2016). Epigenetisk påvirkning af fosterets udvikling. Ugeskrift for Læger, 178:V02160132, 2-5. https://content.ugeskriftet.dk/sites/default/files/scientific_article_files/2016-11//V02160132_2.pdf
Feinberg, A.P. (2008). Epigenetics at the epicenter of modern medicine. JAMA, 299(11), 1345–1350. https://doi.org/10.1001/jama.299.11.1345
Grønbæk, E. S. & Sommer, D. (2019). Epigenetik og udviklingstransaktioner i den tidlige tilknytningsrelation. Psyke & Logos, 40, 189-207. https://tidsskrift.dk/psyke/article/view/117818
Hamilton, J.P. (2011). Epigenetics: principles and practice. Digestive diseases, 29(2), 130–135. https://doi.org/10.1159/000323874
Jirtle, R.L. & Skinner, M.K. (2007). Environmental epigenomics and disease susceptibility. Nature reviews. Genetics, 8(4), 253–262. https://doi.org/10.1038/nrg2045
Kitaba, N. T., Knudsen, G. T. M., Johannessen, A., Rezwan, F. I., Malinovschi, A., Oudin, A., Benediktsdottir, B., Martino, D., González, F. J. C., Gómez, L. P., Holm, M., Jõgi, N. O., Dharmage, S. C., Skulstad, S. M., Watkins, S. H., Suderman, M., Gómez-Real, F., Schlünssen, V., Svanes, C., & Holloway, J. W. (2023). Fathers’ preconception smoking and offspring DNA methylation. Clinical epigenetics, 15(1), 131. https://doi.org/10.1186/s13148-023-01540-7
McCartney, D. L., Stevenson, A. J., Hillary, R. F., Walker, R. M., Bermingham, M. L., Morris, S. W., Clarke, T. K., Campbell, A., Murray, A. D., Whalley, H. C., Porteous, D. J., Visscher, P. M., McIntosh, A. M., Evans, K. L., Deary, I. J., & Marioni, R. E. (2018). Epigenetic signatures of starting and stopping smoking. EBioMedicine, 37, 214–220. https://doi.org/10.1016/j.ebiom.2018.10.051
Nicoglou, A., & Merlin, F. (2017). Epigenetics: A way to bridge the gap between biological fields. Studies in history and philosophy of biological and biomedical sciences, 66, 73–82. https://doi.org/10.1016/j.shpsc.2017.10.002
Painter, R.C., Roseboom, T.J. & Bleker, O.P. (2005). Prenatal exposure to the Dutch famine and disease in later life: an overview. Reprod Toxicol. 20:345–352. https://pubmed.ncbi.nlm.nih.gov/15893910/
Sonne-Hansen, K., Etzerodt, C. & Helin, K. (2014). Fra genetik til epigenetik. Aktuel Naturvidenskab, 3, 36-40. https://aktuelnaturvidenskab.dk/fileadmin/Aktuel_Naturvidenskab/nr-3/AN3-2014epigenetik.pdf
Weaver, I., Cervoni, N., Champagne, F. et al. (2004). Epigenetic programming by maternal behavior. Nat. Neuroscience, 7, 847–854. https://doi.org/10.1038/nn1276
Xavier, M. J., Roman, S. D., Aitken, R. J., & Nixon, B. (2019). Transgenerational inheritance: how impacts to the epigenetic and genetic information of parents affect offspring health. Human reproduction update, 25(5), 518–540. https://doi.org/10.1093/humupd/dmz017
[1] Epigenetics and the influence of our genes, Courtney Griffins, TEDxOU, https://www.youtube.com/watch?v=JTBg6hqeuTg
[2] Epigenetics: Unraveling the Mysteries of Nature & Nurture, Natalia Husby, TEDxUniversityofDelaware – https://www.youtube.com/watch?v=XE6oQgjEyqU
[3] How genetics and environment work together to shape our destiny: Milena Georgieva at TEDxAUBG – https://www.youtube.com/watch?v=gfDIkwoAbPk